Vừa qua, Cục Quản lý Dược, Bộ Y tế đã ban hành Công văn số 10927/QLD-CL thông báo thu hồi lô thuốc Viên nén LIV-Z Tablets trên địa bàn Thành phố Hà Nội.
Căn cứ vào các qui chế dược hiện hành của Việt Nam.
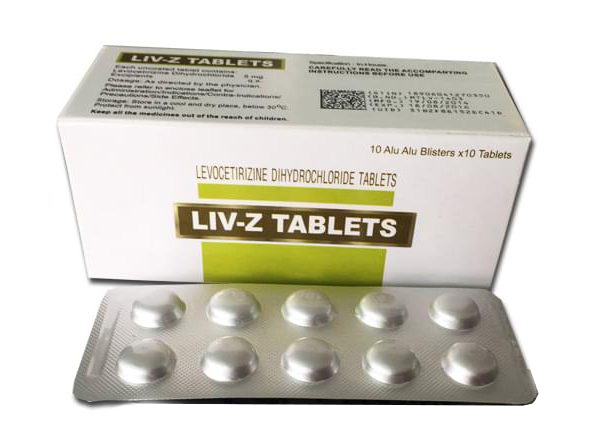
Căn cứ Công văn số 387/VKNTTW-KH ngày 21/6/2019 gửi kèm phiếu kiểm nghiệm số 49Gt34 ngày 21/6/2019 của Viện kiểm nghiệm thuốc TW, Cục Quản lý Dược đã ban hành Công văn số 10927/QLD-CL ngày 03/7/2019 thông báo thu hồi trên địa bàn Thành phố Hà Nội lô thuốc Viên nén LIV-Z Tablets (Levocetirizine dihydrochloride 5mg), SĐK: VN-18014-14, số lô: MYTHB1801, NSX: 06/03/2018, HD: 05/03/2020 do Công ty Maxtar Bio-Genics – India (India) sản xuất, Công ty cổ phần dược liệu Trung ương 2 (Phytopharma) nhập khẩu.
Căn cứ Công văn số 523/VKNT-KHTH đề ngày 14/10/2019 của Viện kiểm nghiệm thuốc Tp. Hồ Chí Minh gửi kèm phiếu kiểm nghiệm số 1629/VKNYC2019 và Phiếu kiểm nghiệm số 1630/VKN-YC2019 ngày 14/10/2019 báo cáo kết quả lấy mẫu bổ sung đối với lô thuốc Viên nén LIV-Z Tablets, số lô: MYTHB1801, NSX: 06/03/2018, HD: 05/03/2020 nêu trên. Theo đó, khi tiến hành phân tích bổ sung bằng phương pháp HPLC sử dụng cột tách đồng phân, thì kết quả sắc ký đồ của mẫu thuốc xuất hiện 2 pic: R-Cetirizin và Levocetirizin tương tự sắc ký đồ của Cetirizin

Sau khi xem xét hồ sơ kiểm nghiệm và các tài liệu liên quan, nhận thấy, Levocetirizin là một trong 2 thành phần quang học của Cetirizin, mẫu thuốc chứa Cetirizin. Để đảm bảo chất lượng, an toàn và hiệu quả điều trị của thuốc và có đầy đủ căn cứ xử lý tiếp theo, Cục Quản lý Dược thông báo:
1. Tạm dừng nhập khẩu, phân phối, sử dụng mặt hàng thuốc Viên nén LIVz Tablets (Levocetirizine dihydrochloride 5mg) do Công ty Maxtar Bio-Genics – India sản xuất.
2. Yêu cầu Công ty cổ phần dược liệu Trung ương 2 phối hợp với Công ty Maxtar Bio-Genics – India (India), các công ty của Việt Nam nhập khẩu và phân phối thuốc LIV-Z tablets:
– Tạm dừng nhập khẩu, phân phối các lô thuốc Viên nén LIV-Z Tablets (Levocetirizine dihydrochloride 5mg) Công ty MaxtarBio-Genics -India sản xuất.
– Trong thời hạn 48h kể từ ngày ký Công văn này, gửi thông báo tạm dừng phân phối, sử dụng tới các cơ sở bán buôn, bán lẻ, sử dụng đã được cung ứng thuốc Viên nén LIV-Z Tablets (Levocetirizine dihydrochloride 5mg) do Công ty Maxtar Bio-Genics – India (India) sản xuất nêu trên.
– Báo cáo về Cục Quản lý Dược trước 12h ngày 22/10/2019 về việc cung ứng, nhập khẩu vào Việt Nam thuốc Viên nén LIV-Z Tablets (Levocetirizine dihydrochloride 5mg) trong thời gian từ 01/6/2017 đến nay (số lô, ngày sản xuất, ngày hết hạn, ngày nhập, số lượng nhập khẩu và tình hình phân phối thuốc).
– Phối hợp với các cơ quan kiểm tra chất lượng, cơ quan kiểm nghiệm thuốc nhà nước tiến hành lấy mẫu thuốc của tất cả các lô thuốc LIV-Z Tablets (Levocetirizine dihydrochloride 5mg); gửi mẫu tới Viện Kiểm nghiệm thuốc Trung ương hoặc Viện Kiểm nghiệm thuốc Tp. Hồ Chí Minh để tiến hành phân tích định tính và định lượng thành phần hoạt chất của thuốc.
4. Đề nghị Viện Kiểm nghiệm thuốc TW, Viện Kiểm nghiệm thuốc Tp. Hồ Chí Minh:
– Ưu tiên tiến hành lấy mẫu để kiểm tra chất lượng đối với ít nhất 02 lô thuốc Viên nén LIV-Z Tablets (Levocetirizine dihydrochloride 5mg) do Công ty Maxtar Bio-Genics – India (India) sản xuất và tiến hành phân tích định tính, định lượng thành phần hoạt chất của thuốc (phân biệt Levocetirizin và Cetirizin).
– Báo cáo kết quả về Cục Quản lý Dược để có căn cứ xử lý tiếp theo.
4. Sở Y tế các tỉnh thành phố trực thuộc TW, Y tế các ngành thông báo cho các cơ sở kinh doanh, sử dụng thuốc tạm dùng phân phối, sử dụng thuốc Viên nén LIV-Z Tablets (Levocetirizine dihydrochloride 5mg) nêu trên, kiểm tra và giám sát các đơn vị thực hiện thông báo này; xử lý những đon vị vi phạm theo quy định hiện hành; báo cáo về Cục Quản lý Dược và các cơ quan chức năng có liên quan.
Cục Quản lý Dược thông báo để các đơn vị biết và thực hiện ./.